의료기기 의 생물학적 평가는 의료기기기준규격 (
https://www.law.go.kr/admRulLsInfoP.do?admRulSeq=2100000197529 )에서 명시하는 의료기기에 대하여 적용이 됩니다.
?
의료기기 기준규격에서는 I. 의료용품 및 치과재료에 고형근관충전재를 포함한 39개 품목, II. 기구기계에 가스마취기를 포함한 81개 품목, III. 1등급 의료기기에 근관치료용페이퍼포인트를 포함한 136개 품목이 설명되어 있습니다.
?
의료기기의 생물학적 안전에 관한 공통기준규격(
https://www.law.go.kr/admRulLsInfoP.do?admRulSeq=2100000187140 )에서 의료기기의 생물학적 안전에 관한 공통기준 및 시험방법에 상세한 내용으로 설명하고 있습니다.
?
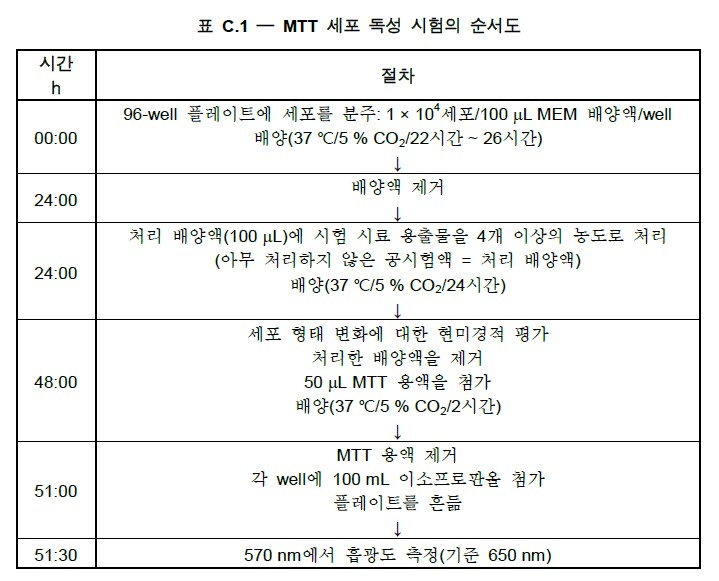
공통기준규격 제5장에서는 체외( in vitro)에서 의료기기의
#세포독성 을 평가하는 방법을 설명 하고 있으며 직접적 또는 확산을 통해 의료기기 자체 및(또는) 용출물을 접촉시켜 세포를 배양하는 방법을 설명하고 있습니다.
?
세포독성에는 다양한 세포주들이 사용되지만 천연물 등의 세포독성평가 에는 Raw 264.7 세포주가 일반적으로 사용되지만,
#의료기기의세포독성 은 CCL1, CCL 163, CCL 171, CCL 75, CCL 81, CCL 10, V-79 379A 등의 세포를 이용하도록 권고하고 있으며 당 사에서는 NCTC clone 929; NCTC clone 929 ;L-929 세포주를 사용해서 테스트를 진행하고 있습니다.
?
공통기준 및 시험방법의
세포독성평가는 ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for
in vitro
cytotoxicity와 의료기기의 생물학적 평가 - 제5부: 세포독성시험 - 체외시험 KS P ISO 10993-5의 시험법으로 적용 할 수 있습니다.
?
의료기기는 제품을 개발하는 과정에서 수많은 내부 연구용 또는 참고용 데이터가 필수적으로 발생하게 됩니다.
?
내부 연구용이나 참고용 데이터의 경우 저렴한 비용으로 신속하게 확인해서 수정이나 보완의 개발 과정을 거쳐서 최종 제품을 빠르게 출시하는 것이 유리합니다.
?
우리 올패스바이오는
내부 연구용이나 참고용 데이터 확보를 위한 의료기기의 세포독성 평가를 진행 하고 있습니다.
?
의료기기의 세포독성 평가는 인체 피부와 접촉하는 의료기기의 세포독성을 평가하며 NCTC clone 929(L-929) 섬유아세포를 사용하며
정성적 평가 결과 반응도가 2등급보다 큰 경우 세포 독성이 있는 것으로 간주하고
정량적 평가 결과 세포 생존율이 30% 이상 감소되면 세포 독성이 있는 것으로 판정하게 됩니다.